Points clés
- Indications : cancers de faible risque PSA inférieur à 10, Gleason inférieur à 7 (parfois certains 7), tumeur non palpable ou qui touche moins d’un lobe
- Idéal quand la lésion est au milieu d’un lobe
- Ils ne sont pas remboursés sauf les ultrasons dans certaines indications ou sous protocole d’essai
- La géolocalisation des lésions est primordiale
- Traitement entre la surveillance active et les traitements radicaux.
Pourquoi émerge ce concept de thérapies focales avec tous ces débats ? Pour qui cela peut-il être intéressant ? Comment peut-on réaliser ces thérapies focales ?
Entre le chaud, le froid, les radiations et l’électricité, il existe différentes techniques très efficaces pour détruire la tumeur, plus ou moins adaptées à chaque personne avec des avantages et des inconvénients mais il faut respecter des critères importants. L’enjeu majeur est la géolocalisation du cancer par l’imagerie.
Si on regarde l’évolution des connaissances sur le cancer de la prostate, la thérapie focale est une révolution. Pas au sens d’une révolution nouvelle mais plutôt d’un cycle sur les concepts. Les premiers traitements focaux proposés datent de 1955. Cela revient aujourd’hui à la mode avec de nouvelles technologies. Comme la prostatectomie, dont le concept et les bases du traitement ont été établis entre 1866 et 1905.
Traitement focaux du cancer de la prostate : pourquoi ?
Exposition au sur-traitement des cancers à pronostics favorables
Le surtraitement pour les petits cancers de la prostate était notamment lié à l’utilisation du dosage du PSA comme outil de diagnostic précoce. Le PSA n’est pas un très bon test, mais il est le meilleur dont on dispose aujourd’hui. Il agit comme un signe d’alerte pour déclencher des examens plus approfondis : investiguer et diagnostiquer le cancer de la prostate. Grâce au progrès de l’imagerie, on peut aujourd’hui mieux identifier le profil des différents types de cancers de prostate.
Nouvelles tendances de l’épidémiologie du cancer de la prostate : en moyenne, voici le volume des cancers de prostate :
- 6 cm3 au diagnostic en 1989
- 2 cm3 au diagnostic dans les années 2000
- quasiment en dessous de 1 cm3 lors du diagnostic de nos jours. Plus de la moitié sont dits à « pronostics favorables » : ils ne sont pas palpables ou à peine palpables au toucher rectal avec un PSA en dessous de 10 et un score d’agressivité de Gleason faible. Ils représentent ceux qui sont potentiellement exposés au surtraitement.
Le fait d’enlever ou de traiter toute la prostate pour un cancer est une attitude excessive. C’est une stratégie caduque. Il faut vivre avec les technologies et les connaissances de son temps. La connaissance même du cancer de la prostate a beaucoup évolué, nous pouvons l’appréhender de mieux en mieux. Nous ne sommes pas obligés de le détruire systématiquement. Il est possible de négocier ou de temporiser à certains moments.
La prostatectomie radicale mérite-t-elle encore d’être un étalon d’or ?
Le débat peut aussi être enrichi avec l’efficacité relative des traitements radicaux comme la prostatectomie. Des études randomisées avec un suivi de 15 ans ont comparé des hommes opérés contre des hommes surveillés (étude PROTECT). On n’observe pas vraiment de différences significatives au long terme sur la mortalité pour deux raisons :
- après 15 ans, chez les personnes simplement observées, entre 15 et 20% vont décéder d’un cancer de la prostate. Ce n’est pas négligeable mais cela signifie aussi que 80 à 85% des patients dans le groupe ayant subi une prostatectomie ont été surtraités.
- si on applique une prostatectomie, cela ne change quasiment pas l’évolution de la maladie. Cela signifie qu’au moment du diagnostic, pour ces 15 à 20 % de patients supposés traitables par chirurgie (pas de signes d’extension en dehors de la prostate), il était déjà trop tard : des cellules étaient parties ailleurs et le traitement n’a rien changé à l’évolution de la maladie déjà critique dans l’application de traitements locaux de la prostate.
En revanche, ce qui est très significatif sur le suivi à 15 ans, c’est la différence sur la dysfonction érectile et l’incontinence urinaire liée au traitement.
Une étude prospective de développement pour le cancer de la prostate localisé avec un ou plusieurs foyers :
Les premiers résultats de traitements focaux (Hashim U ahmed et al. 2012;13:622-32) ont été publiés dans le Lancet Oncology, revue sérieuse avec des résultats vérifiés et transparents. Le traitement proposé utilise des ultrasons focalisés. Les résultats de cette étude pilote indiquent :
- Seulement 3 cas sur 39 de tumeurs résiduelles, sachant que l’on peut retraiter puisqu’il s’agit d’un traitement focal.
- La disparition des tumeurs sur les biopsies consécutives au traitement du cancer pour la majorité des patients.
- D’excellents résultats sur le plan fonctionnel. Le premier mois, petite baisse des différents paramètres, mais récupération quasi complète pour l’ensemble de la population traitée, en particulier, pas de troubles de la continence et une dysfonction érectile restant en dessous de 15 % pour ce groupe de patients.
Incertitudes de stratégie de prise en charge, bénéfice/risque du traitement (& dépistage)
Pour ces cancers à faibles risques se pose le choix de la prise en charge : de la surveillance active aux traitements radicaux comme la curiethérapie, la radiothérapie externe, la prostatectomie…
La stratégie se base sur une classification anatomo-clinique (classification pronostique – modalités de surveillance) et sur une évaluation de la biologie (agressivité, multi-foyers).
Pour chaque patient appartenant au groupe à faible risque évolutif, toutes les options thérapeutiques restent envisageables. Il est crucial de prendre des décisions éclairées en se basant sur des paramètres permettant de déterminer si le risque d’évolution de la maladie est plus élevé – à condition de disposer des arguments nécessaires pour étayer cette évaluation. Par ailleurs, certaines situations peuvent poser des défis spécifiques : un patient, par exemple, pourrait être excessivement inquiet en raison d’une petite lésion et insister pour un traitement, alors que cela n’est pas forcément justifié. À l’inverse, un autre patient pourrait présenter une lésion partielle mais agressive et supposer à tort qu’une simple surveillance suffit.
Arguments des partisans et des opposants aux traitements focaux
Les partisans des traitements focaux mettent en avant les résultats cliniques :
- le faible risque pour ces cancers (dont certains pourraient être renommés sous le terme « lésions précancéreuses » plutôt que sous le terme « cancer »).
- le surtraitement et la perte de qualité de vie
- le bénéfice en termes de survie par rapport au traitement total n’est pas prouvé pour les bas risques, ce qui est en effet le cas,
- la chirurgie partielle est un standard pour des cancers plus agressifs que les cancers de la prostate (rein, vessie, sein). Le cancer de la prostate reste, pour des lésions de petite taille de faible agressivité, celui qui est encore exposé à un traitement radical où tout l’organe est traité alors que c’est devenu maintenant une quasi-exception parmi les autres cancers.
Les opposants aux traitements focaux mettent en avant les observations des biopsies :
- le cancer de la prostate a souvent plusieurs lésions cancéreuses au sein de l’organe.
- avec une thérapie focale, il faut extrêmement bien évaluer les limites de la tumeur. On peut laisser des marges cancéreuses.
- même en surveillance active, on reste en permanence en suivi avec une nécessité de surveillance qui peut être agressive par la répétition des biopsies.
Réf. : Gleason Score 6 Adenocarninoma : should it be labeled as Cancer ? Journal of Clinical Oncology – V30 – N35 – December 10 2012
Principe du traitement focal
Il s’agit d’une nouvelle façon de penser le cancer de la prostate et la manière dont il doit être « apprécié » et, éventuellement, traité. La philosophie du traitement radical est d’éradiquer la maladie bien qu’il existe entre 10 et 20% d’échec. La philosophie du traitement focal est un peu plus subtile : il va impacter l’histoire naturelle de la maladie, en surveillant les petits foyers qui peuvent évoluer et en gérant le temps.
La théorie de la lésion Index
On part du principe que le cancer de la prostate est un cancer multifocal (plusieurs foyers) dans 80 % des cas, composé d’une lésion principale (lésion Index) associée à une ou plusieurs lésions secondaires de petit volume, de plus faible agressivité, sans risque d’évolution métastatique à priori.
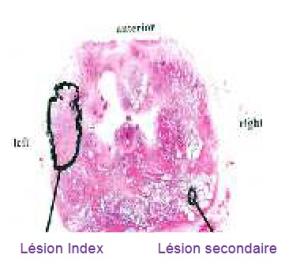
Quelle lésion traiter : la lésion Index
La lésion Index est celle qui va imprimer le rythme de la maladie et qui va donner le « pronostic ». Il s’agit de la lésion :
- avec le score de Gleason principal
- qui représente 80 % du volume tumorale
- responsable de la progression tumorale
- habituellement, la plus volumineuse ou la plus agressive. Quand on regarde les patients décédés de métastases multiples, on constate qu’un seul foyer parent est à l’origine de l’ensemble des métastases : la tumeur « Index ». Mais certaines preuves montrent que ce n’est pas toujours la plus volumineuse qui est la plus agressive sur le plan moléculaire.
Les thérapies focales cherchent à l’identifier cette tumeur « Index », car c’est celle qu’il faut traiter, ce n’est pas la peine de s’intéresser aux autres.
La thérapie focale est basée sur le concept suivant : à partir du moment où on va détruire cette lésion Index, on considère avoir changé l’histoire naturelle de la maladie : on retarde son évolution voire on la bloque définitivement. Elle va soit ralentir, soit disparaître. La petite lésion sera surveillée. Le patient conserve alors sa prostate et évite les effets secondaires liés aux traitement radicaux.
Des études, publiées dans Nature Medecine, ont montré que dans le cancer de la prostate, les métastases partaient d’un clone, qui elles-mêmes pouvaient éventuellement donner des métastases. Donc si on cible ce clone, on change l’histoire naturelle de la maladie, on joue avec le temps. Tout est une question de temps dans le cancer de la prostate.
Traitement focaux du cancer de la prostate : POUR QUELS PATIENTS ?
Groupe de patients à faible risque d’évolution
Aujourd’hui, les traitements focaux sont réservés au groupe de patients à faible risque et même à très faible risque candidats à la surveillance active. Selon la classification de D’AMICO, il s’agit de tumeurs dont le PSA est inférieur à 10 avec un score de Gleason inférieur à 7 et une tumeur non palpable ou qui touche moins d’un lobe.
Cette classification a été affinée grâce au système CAPRA, qui prend en plus en compte le nombre de biopsies positives (sur un total standard de 12 prélèvements). Ce système inclut également des paramètres tels que l’âge, le taux de PSA, le score de Gleason et le stade clinique (présence ou absence de tumeur palpable). Le score obtenu permet de classer les patients en trois catégories de risque : faible, intermédiaire et élevé.
EN SAVOIR PLUS SUR D’AMICO ET CAPRA
Cancers de la prostate à très faible risque : ce qu’il faut savoir
Les cancers localisés, selon la classification de D’AMICO 1, représentent environ 50 % des cas à faible risque évolutif. Parmi eux, un sous-groupe dit à très faible risque, souvent supposé comme « indolent » est éligible à la surveillance active. Ces tumeurs sont petites (moins de 10 mm de diamètre) et se traduisent généralement par moins de 3 biopsies positives, avec une faible proportion de tissu tumoral.
Cependant, des erreurs de classification surviennent dans 20 % des cas, en raison des variations du PSA liées au volume prostatique, à l’obésité ou à certains médicaments. De plus, le toucher rectal et le score de Gleason manquent parfois de précision. Cette incertitude souligne l’importance d’une évaluation approfondie pour adapter au mieux la prise en charge.
EN SAVOIR PLUS SUR LES FAIBLES ET TRÈS FAIBLES RISQUES
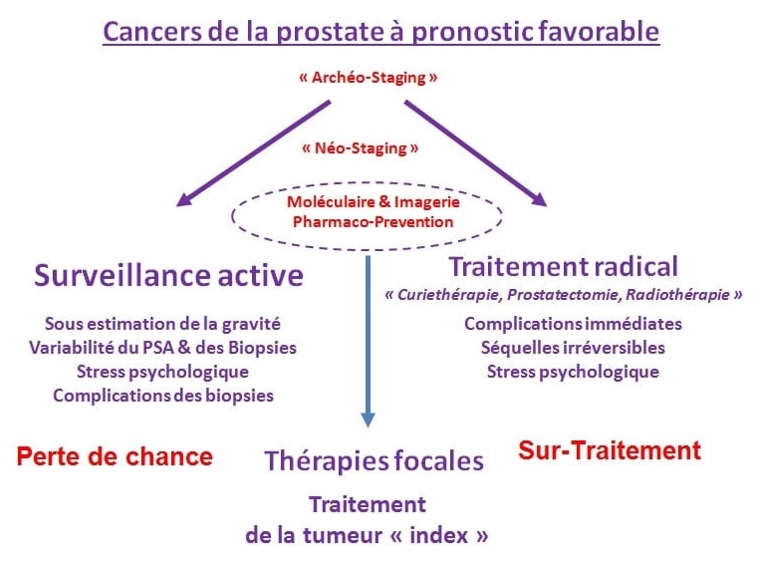
L’importance du staging pour le choix du traitement focal
En opposant les notions de bénéfices/risques, de perte de chance ou de surtraitement, les thérapies focales se placent entre la surveillance active et le traitement radical à condition de pouvoir traiter cette tumeur index. Les thérapies focales peuvent également réduire l’anxiété chez certains patients, car elles offrent un traitement actif du cancer, contrairement à la surveillance active qui peut susciter la crainte (souvent injustifiée) d’une progression de la maladie.
Le staging (analyse précise du cancer) qui évalue et classe l’étendue et la gravité du cancer à partir du PSA, des biopsies, du score de Gleason et du toucher rectal est dépassé (archéo-staging dans le schéma). Il faut un staging plus performant où il existe des progrès. L’IRM avec l’imagerie et les tests moléculaires permettent d’améliorer ce staging pour apprécier l’agressivité des tumeurs et avoir une meilleure vision, ne serait-ce que de leur volume. La pharmaco-prévention (traitement hormonal de trois mois, sujet présenté lors d’une journée scientifique médecins-patients de ANAMACaP) pourrait faire partie de ce tri des lésions : certaines disparaissent au bout de ces trois mois de traitement. D’autres pas, c’est alors la signature de celles qu’il faut traiter, soit de façon radicale, soit potentiellement par des thérapies focales si cela est possible.
L’imagerie : un outil essentiel pour l’indication d’un traitement focal
L’IRM a fait de gros progrès : on a pu rendre visible, l’invisible. La première phase dans l’indication d’un traitement focal est la caractérisation du cancer et la géolocalisation exacte de la maladie. Avec l’IRM multiparamétrique, des images permettent d’apprécier l’anatomie de la prostate. Il est possible de situer précisément le cancer et d’offrir le traitement personnalisé qui convient au patient. On peut ajouter d’autres paramètres sur ces images tels que :
- des mesures qui reflètent la vascularisation et le timing de cette vascularisation dans la prostate au cours de l’examen avec l’injection d’un produit de contraste
- l’existence de la cohésion entre les cellules ou de la spectroscopie (agressivité).
Pour avoir une bonne IRM multiparamétrique, au moins deux de ces trois paramètres doivent être fonctionnels.
Au sein de prostates étudiées, on a essayé de corréler le volume des tumeurs Index sur la prédiction de l’agressivité. On observe que la densité du PSA et que le score de Gleason sont reliés au volume de la tumeur Index. Mais cela n’est pas vrai dans 100 % des cas. Le nombre de foyers dans la prostate n’a pas de lien avec l’agressivité de la maladie.
Grâce au progrès de l’IRM, les images peuvent être fusionnées avec l’échographie pour localiser précisément les régions suspectes où effectuer les prélèvements de biopsies. Cela permet un suivi précis grâce à une sorte de « GPS » et une mémorisation des données. Cet outil est indispensable pour envisager des thérapies focales.
D’autre part, l’IRM multiparamétrique est importante car elle évalue la tumeur en utilisant deux paramètres clés : le volume tumoral et l’ADC (Apparent Diffusion Coefficient) qui apprécie l’agressivité. Plus l’ADC est élevé (>800-900), moins la tumeur est agressive. Si des paramètres IRM (volume ou ADC) contredisent un score de Gleason faible de 6, cela peut indiquer une tumeur plus agressive nécessitant de nouvelles biopsies pour confirmation.
Traitement focaux du cancer de la prostate : COMMENT ?
Déroulé d’un traitement focalisé pour le cancer de la prostate
La plupart des traitements focaux sont basés sur le modèle de la curiethérapie : un repérage avec la mise en place d’aiguilles par voie rectale sous contrôle échographique. Seule l’énergie délivrée est différente. Ils sont peu invasifs. Le traitement est réalisé sous anesthésie générale. La durée d’hospitalisation varie de 1 à 2 jours avec possibilité de traitement en ambulatoire. On utilise une sorte de grille de « bataille navale » vraiment adaptée à l’imagerie moderne qui permet de cartographier les tumeurs. On peut planifier de façon tout à fait précise les traitements grâce à l’IRM pour les lésions visibles qui seront traitées. Cette modélisation et ce pré-planning thérapeutique sont utilisés avant un traitement focal où les images sont reconstruites en 3 dimensions. Ce qui compte, c’est la planification pour effectuer le traitement au bon endroit, pas le choix de l’énergie. Par exemple, une lésion située dans la partie antérieure de la prostate (zone à l’opposée du rectum) peut être enlevée par un traitement focal, périmètre dont on possède parfaitement les limites grâce à la cartographie. Le traitement sera contrôlé de façon assez précise grâce aux techniques d’imagerie, de personnalisation et de modélisation avant traitement.
Les types de traitements focaux et l’énergie utilisée :
Le chaud : les ultrasons focalisés (Focal One), méthode la plus ancienne (années 90), avec des améliorations techniques dans le temps : le but est de brûler, de détruire par la chaleur. C’est le cas aussi des traitements par radiofréquences (micro-ondes) plutôt utilisées pour le rein et de façon plus rare pour la prostate. Les ultrasons sont délivrés par une sonde endorectale. Elle peut être utilisée pour traiter des récidives à l’intérieur de la prostate après radiothérapie ou comme alternative aux traitements radicaux. Les complications sont rares mais peuvent être graves : fistules rectales et incontinence urinaire permanente.
EN SAVOIR PLUS SUR LES ULTRASONS
Le froid : par la cryothérapie en congelant la lésion à – 40° avec des cryosondes implantées avec des aiguilles sous contrôle échographique par voie endorectale.
La lumière : par la photothérapie dynamique qui consiste à injecter un produit photosensibilisant. On met dans l’aiguille une fibre laser sous contrôle échographique par voie endorectale. Le tissu sera détruit uniquement par le photosensibilisant autour de la région éclairée à l’intérieur de la prostate par cette aiguille.
Les rayons : par la curiethérapie prostatique focalisée : insertion de grains radioactifs dans la prostate, mais au lieu de traiter l’ensemble de la glande, on ne traite que la région où la tumeur est présente.
Par la tomothérapie, qui est une radiothérapie permettant de dessiner parfaitement un volume dans la prostate avec une résolution centimétrique et d’irradier seulement ce volume. Elle permet de faire du traitement anatomique en termes de radiothérapie externe.
Par la radiothérapie stéréotaxique et la protonthérapie : radiothérapie très précise qui ne délivre son énergie que sur le volume déterminé. C’est un système très performant développé surtout pour les tumeurs cérébrales au départ, avec une résolution millimétrique, qui permet d’avoir une précision très importante sans irradiations sur les points d’entrées externes. L’énergie est uniquement délivrée à l’intérieur du tissu.
L’électricité (électroporation, nanoKnife) : on utilise entre deux aiguilles un champ électrique de haute intensité sous contrôle échographique par voie endorectale. Cela a été développé pour des tumeurs inopérables, parce qu’elles envahissaient les structures vasculaires ou nerveuses vitales. L’électroporation détruit les structures cellulaires, mais garde toute la structure des vaisseaux, des nerfs, des enveloppes. En l’utilisant sur un vaisseau, cela détruit momentanément les cellules vasculaires mais cela garde tout la structure du vaisseau qui continue à fonctionner et à se régénérer. Même chose pour les nerfs. C’est une technique très encourageante.
Ces techniques partagent l’avantage de préserver les érections et de limiter le risque d’incontinence urinaire, sauf lorsque la zone traitée s’étend sur les limites de la prostate. En cas d’échec, il reste possible de recourir à un retraitement focal ou à un traitement complet classique.
Problématique et inconvénients des traitements focalisés
La problématique des traitements focaux réside dans le compromis entre la préservation de l’anatomie et l’efficacité de la technologie. Ces traitements visent à limiter les effets secondaires tels que les troubles de la fonction sexuelle et l’incontinence urinaire. L’objectif est de préserver autant que possible les structures nerveuses situées de chaque côté de la prostate, essentielles aux érections, ainsi que le sphincter, le canal urétral et le col de la vessie, pour garantir la continence tout en ciblant le cancer avec une grande précision. Par ailleurs, la proximité du rectum impose une vigilance particulière, car des dommages tels que des brûlures ou une congélation pourraient nécessiter la mise en place d’un anus artificiel.
On propose des effets ablatifs qui font « un trou » sauf avec l’électroporation. La difficulté est que 70 % des cancers se trouvent dans la région postérieure de la prostate (proche du rectum). En fonction des techniques utilisées (chaud, froid, lumière), il faut avoir une marge de sécurité d’au moins 5 mm à l’arrière pour éviter de faire un trou dans le rectum. Idem pour les nerfs érecteurs. C’est une des limites de ces traitements ablatifs.
L’éjaculat est généralement fortement réduit, voire supprimé. En présence d’un adénome associé au cancer, il est essentiel de le traiter, car il peut entraîner un risque de rétention vésicale (difficulté ou une incapacité à vider complètement la vessie) après le traitement focal.
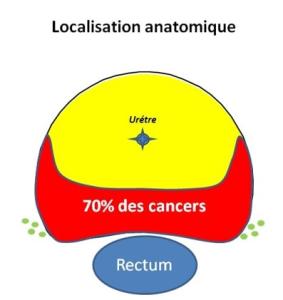
Les techniques de radiothérapie sont un peu plus séduisantes car leur résolution et la précision de la dose délivrée est excellente à quelques mm près. La zone est préservée au maximum, plus réduite en arrière, on peut donc traiter davantage de foyers cancéreux postérieurs, puisqu’ils représentent 70 % de la localisation des cancers de prostate. L’électroporation, pourra être une solution encore plus séduisante.
La thérapie focale est idéale quand un cancer est situé en plein milieu d’un lobe.
CONCLUSION
Les traitements focaux constituent une alternative intéressante aux traitements conventionnels du cancer de la prostate pour certains patients. En ciblant spécifiquement les tumeurs, ils permettent de réduire les effets secondaires et d’améliorer la qualité de vie. Cependant, leur utilisation reste limitée par des critères d’inclusion précis et nécessite une évaluation personnalisée au cas par cas.
La réflexion évolue actuellement en France à l’heure où les traitements focaux ne sont pas dans les recommandations. Ils sont réalisés dans des protocoles de recherche clinique qui visent essentiellement à les comparer à la surveillance active.
Les groupes anglais ont un programme plus ambitieux et proposent de traiter focalement des tumeurs plus agressives (score de Gleason 7) à partir du moment où l’ensemble du volume tumoral peut être traité. Ils comparent les thérapies focales à la prostatectomie ou aux traitements curatifs, même pour les tumeurs de haut grade. Cette démarche, avec ses perspectives, donne une vision de type : « volume curable totalement. » On s’approche d’une évolution comme pour le cancer du sein où l’on dispose de traitements combinés et où le sein n’est plus enlevé de façon globale.
Vous pouvez en discuter avec votre urologue afin de savoir si les traitements focaux sont adaptés à votre situation personnelle.
Questions – réponses
Roland MUNTZ, président : L’efficience de toutes ces thérapies focales n’est-elle pas corrélée à l’évolution des techniques de l’imagerie ? Dans le futur, avec un Tesla à 20 ou plus par exemple, à partir du moment où on aura une cible bien déterminée, c’est évidemment le CyberKnife qui va gagner.
Réponse du Pr Cussenot : L’évolution est en effet l’imagerie. Aujourd’hui, on a déjà une option. Avec une 1.5 Tesla et à fortiori avec une 3 Tesla. En France et si vous ne voyez rien en IRM, ce n’est pas la peine de faire des biopsies au hasard. On sait que vous n’allez jamais trouver de lésions qui vont faire plus de 3 ou 5 mm, on est bien en deçà. Il vaut mieux surveiller par l’IRM que d’imposer des biopsies. Vous avez quand même une tranquillité, mais à condition d’avoir l’IRM et la personne qui sait interpréter cette IRM.
Question : En matière de rechute, de récidive locale, les traitements focaux présentent-ils des avantages équivalents aux autres types de stratégie ?
Réponse du Pr Cussenot : On est un peu dans le même débat. Les traitements focaux, pour les récidives locales après les radiothérapies ont été proposés avec de l’HIFU, il y a plus de dix ans, c’était une limite de performance. Aujourd’hui, on peut faire des traitements de rattrapage après la radiothérapie, avec d’autres techniques de radiothérapie de hautes doses : le CyberKnife et la curiethérapie focale sur la zone de récidive. En cas de rechute après une radiothérapie, la question de ne pas pouvoir opérer pour rattraper ne peut plus se poser puisqu’il existe des techniques très performantes de rattrapage.
On observe un taux incompressible de 9 à 10 % de résistance à la radiothérapie pour les cancers de la prostate qui peuvent devenir une récidive locale, on les « rattrape » par des thérapies focales, par le CyberKnife et en fonction de la localisation, par de l’HIFU ou une autre technique. C’est plus difficile après parce que les tissus ont été irradiés et l’HIFU a besoin de cette marge de sécurité de 5 mm. Si la prostate est plus petite et que le rectum est tout près : la grande peur est évidemment de brûler le rectum, car cela fera un trou qui ne cicatrisera jamais. Dans ce cas, il y a un vrai apport des nouvelles techniques comme le CyberKnife ou la curiethérapie focale.
Question : Je voudrais savoir ce que vous pensez des rôles respectifs de l’IRM et des biopsies dans le suivi des thérapies focales, quand on sait qu’après une biopsie, il faut un certain temps pour que l’IRM soit valable puisqu’il y a des remaniements hémorragiques.
Réponse du Pr Cussenot : En cas de suspicion, il vaut mieux faire l’IRM avant, sinon, on est obligé d’attendre au minimum 6 semaines voire un peu plus avec des remaniements hémorragiques. La surveillance active peut être faite en IRM parce qu’on attend environ six mois entre l’IRM et d’autres biopsies potentielles. Le suivi par biopsies était systématique dans la surveillance active. Aujourd’hui avec l’évolution, les équipes qui bénéficient de l’imagerie réalisent des biopsies « ciblées » que dans le cas où une anomalie apparaît ou change sur l’IRM.
Mise à jour en novembre 2024.
Références : cet article a été rédigé à partir des interventions des Professeurs CUSSENOT et AZZOUZI en journées scientifiques médecins patients de l’ANAMACaP en 2014 et 2016 et avec le livre « dans la tourmente de la prostate » des éditions Favre publié en septembre 2020.

