Un cancer de la prostate au stade localisé signifie que le cancer ne s’est pas propagé à d’autres organes ou tissus éloignés. Les médecins parlent « d’absence d’extension du cancer à distance de la prostate ». Après le diagnostic de ce type de cancer, plusieurs options de traitement sont possibles et vous sont présentées. Il vous est souvent demandé de choisir… Voici quelques éléments pour vous éclairer : l’option de prise en charge dépend de plusieurs facteurs. 1) Evaluer les risques d’évolution de la maladie 2) Considérer le bénéfice attendu d’un traitement immédiat en termes de survie par rapport à d’autres causes de mortalité (autres maladies, âge, alcool, tabac) 3) Tenir compte des inconvénients ou des séquelles possibles induites par les traitements.
En milieu d’article, vous trouverez un outil d’aide à la décision par intelligence artificielle offrant une approche éducative que vous pouvez partager avec vos soignants.
PRISE EN CHARGE DES CANCERS DE PROSTATE LOCALISés : CE QU’IL FAUT SAVOIR
La problématique du cancer de la prostate est liée à la prise en charge des stades précoces avec la notion de sur-diagnostic et de sur-traitement.
Évolution et agressivité des cancers localisés
Chaque année, sur les 60 000 nouveaux cas de cancers de la prostate, environ 80% sont diagnostiqués au stade localisé.
- 70% des formes localisées n’ont pas de risque évolutif clair en termes de mortalité ou de progression métastatique à 10 ans voire 20 ans.
- 30% ont donc un risque d’évoluer à 10 et 20 ans.
- Enfin, un sous-groupe minime (0,2% des cas), est considéré comme très agressif avec une évolutivité très rapide même en cas de diagnostic au stade localisé au départ.
La grande majorité des cancers localisés est donc à faible risque de progression (classification 1 de D’Amico) avec une variation en fonction de l’âge au diagnostic. On pense que les cancers diagnostiqués à un âge élevé sont moins graves. En réalité, c’est faux puisque les cancers de faible risque concernent moins de 30% des patients après 75 ans. On a donc un effet « sélectif » du cancer, avec des formes qui évoluent tardivement sur un probable terrain de relative androgéno-dépression ou d’andropause existant. (Note : comme la ménopause chez la femme, l’andropause chez l’homme correspond à une diminution de production de ses hormones sexuelles, testostérone notamment, avec des répercussions au niveau de l’organisme : fatigabilité, baisse de libido, fragilité osseuse etc…).
Les hommes atteints d’un cancer de la prostate après 75 ans sont donc des patients « sélectionnés » pour avoir une maladie agressive. (Note : les cancers de la prostate ayant besoin des androgènes pour proliférer sont moins agressifs. Les cancers qui peuvent évoluer dans un contexte de diminution des androgènes liée a l’âge, sont plus agressifs).
Cette notion se retrouve également en cas de mortalité spécifique, puisque le risque de mortalité par cancer de la prostate est plus élevé en cas de diagnostic à un âge plus avancé.
Incertitude sur l’évolutivité des cancers de la prostate localisés
En termes de survie spécifique liée au cancer de la prostate, on ne trouve aucune différence à 10 ans, entre les groupes radiothérapie, prostatectomie ou surveillance active. Au final, on voit un risque de mortalité de 1% à 10 ans, mais ce taux est valable pour l’ensemble des patients : ceux qui sont traités et ceux qui sont surveillés.
Source : étude PROTECT : « 10-Year Outcomes after Monitoring, Surgery, or Radiotherapy for Localized Prostate Cancer », F.C. Hamdy et al NEJM, September 2016.
Cette étude compare également les effets secondaires (altération de la qualité de vie, dysfonction érectile, continence urinaire) entre les traitements curateurs et la surveillance active qui fait référence.
L’altération de la fonction érectile liée à l’âge, fait que l’altération de la fonction érectile pour la radiothérapie est très proche de la surveillance active (pas de différence significative), au contraire de la prostatectomie où elle est significativement altérée.
Concernant la continence urinaire, quantifiée par le fait de porter une protection par jour, il n’y avait pas de différence significative entre radiothérapie et surveillance active, alors qu’il y en avait une avec la prostatectomie totale où elle est également significativement altérée.
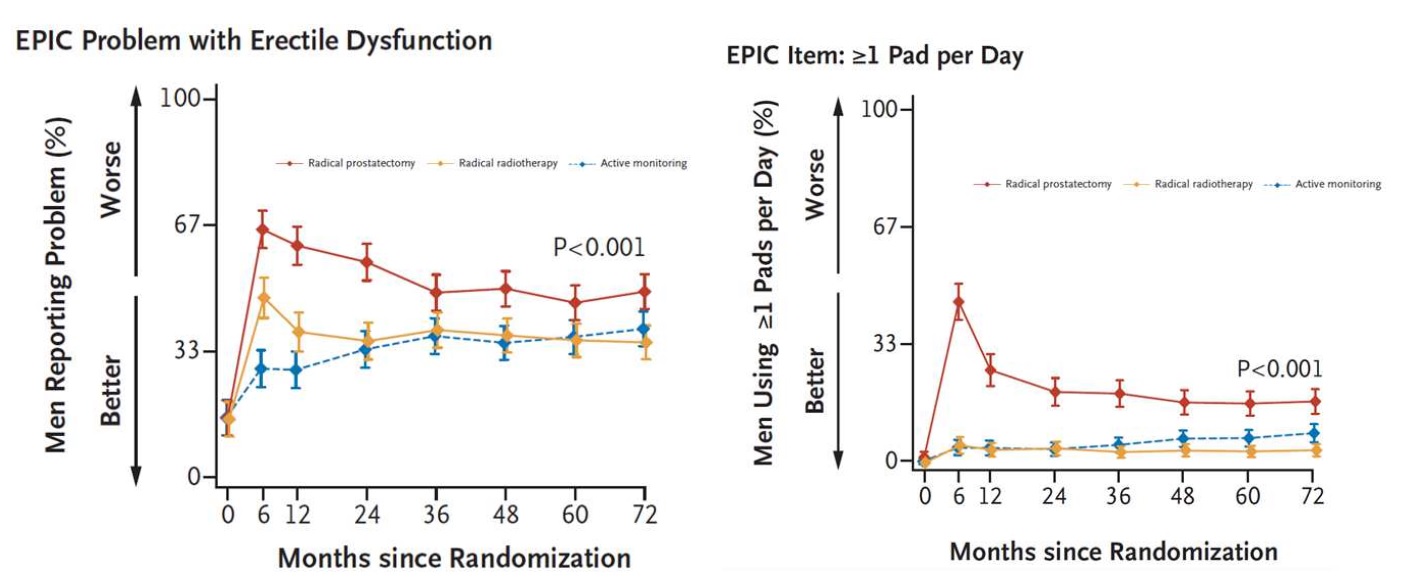
En termes d’incontinence anale et de troubles digestifs, il y avait une différence significative en défaveur de la radiothérapie, alors qu’il n’y en avait pas pour la prostatectomie radicale par rapport à la surveillance active.
A propos de la qualité de vie globale, physique, de l’anxiété ou du score de dépression, il n’y a aucune différence significative entre les groupes, qu’ils soient traités d’une manière ou d’une autre ou en surveillance active.
Comment choisir entre plusieurs options pour les formes localisées ?
Lorsqu’il s’agit de choisir entre deux traitements offrant le même taux de guérison, la préférence se porte généralement sur celui qui présente le moins de risques de complications ou de séquelles. Le traitement peut également être choisi en fonction de celui qui réduira le mieux votre anxiété face à la maladie. Afin de choisir le traitement le plus adapté, il est important d’avoir une vision globale de votre santé et de vos préférences.
A noter : la perception du risque d’évolution du cancer est souvent plus importante que celle portant sur de possibles effets secondaires ou sur le risque de mortalité d’autres facteurs de comorbidités. Exemple : un homme de 65 ans, fumeur, diagnostiqué avec un cancer de la prostate localisé de stade intermédiaire, a un risque de décès à 75 ans de 1 % lié à son cancer. En comparaison, son risque de décès pour d’autres causes est de 22 %. Cela illustre la représentation erronée d’un risque par rapport à l’autre. Références : livre « dans la tourmente de la prostate », éditions Favre.
Le message le plus important reste qu’aujourd’hui, il n’y a pas de différence sur la mortalité entre les différents choix thérapeutiques : prostatectomie, radiothérapie ou curiethérapie pour le traitement des formes localisées de cancer de la prostate.
Prostate Cancer Death After Radiotherapy or Radical Prostatectomy: A Nationwide Population-based Observational Study. European Urology 2017.
Effets secondaires des choix thérapeutiques
Les effets secondaires (fonction sexuelle, continence urinaire) ont également été comparés notamment entre la radiothérapie et la prostatectomie. Sur une étude parue en 2013, on peut observer que les patients ont une meilleure fonction sexuelle dans les 5 ans qui suivent une radiothérapie en comparaison de ceux traités par prostatectomie.
En termes de continence urinaire, l’étude montre qu’il y a un bénéfice (différence significative) pour la radiothérapie par rapport à la prostatectomie (même à long terme 15 ans) et même s’il existe une récupération au bout d’un an pour la chirurgie. Les effets secondaires sur le plan digestif (liés quasi-exclusivement à la radiothérapie), montrent une petite différence avec un bénéfice pour la chirurgie par rapport à la radiothérapie même à long terme sur 15 ans. Cependant cette différence significative est 3 à 4 fois moins importante que la différence liée à la continence urinaire.
1 Long-Term Functional Outcomes after Treatment for Localized Prostate Cancer (N Engl J Med. 2013 January 31; 368(5): 436-445. Doi:10.1056/NEJMoa1209978
En résumé
Pour le cancer de la prostate localisé, certaines perspectives et réflexions ont permis de faire de nombreuses avancées dans la prise en charge de cette pathologie notamment à ce stade.
Le sous-groupe de patients ayant les formes les plus agressives pour qui le traitement radical n’a pas montré de bénéfice en termes de survie, nécessite qu’ils soient mieux identifiés et que le traitement soit plus adapté (0,2% des cas).
Pour les autres groupes, la surveillance active permet d’éviter pour 50% des patients un traitement curatif dans les 10 ans qui suivent le diagnostic. En cas de progression de la maladie, on peut proposer un traitement adapté sans risque d’altérer le risque de décès par rapport à la maladie à terme. Le but est de gagner un certain nombre d’années sans détériorer la qualité de vie (fonction sexuelle et urinaire).
Aujourd’hui, la surveillance active repose sur une meilleure évaluation de la maladie grâce a l’IRM et aux marqueurs d’agressivité. Viennent s’intercaler au milieu des traitements radicaux et de la surveillance active, les thérapies focales qui sont encore en évaluation pour la plupart. Schématiquement, ces thérapies focales sont une forme de surveillance active mais en traitant les lésions lorsqu’elles sont visualisées. Leur enjeu est de réduire de 50% les patients en surveillance active qui basculent vers un traitement radical et ses effets secondaires.
Conseils de l'ANAMACaP
Pour les formes localisées avec un risque faible ou intermédiaire d’évolution, le traitement n’est généralement pas urgent. Cela laisse le temps nécessaire pour choisir l’option la mieux adaptée à chaque patient. D’ailleurs, la surveillance active est généralement suffisante mais elle peut induire de l’anxiété. Lorsque plusieurs traitements ou options sont possibles, il est essentiel de s’informer en rencontrant les experts concernés, chacun ayant une connaissance fine de sa propre spécialité. Une bonne compréhension des avantages et inconvénients de chaque solution vous aidera à prendre une décision partagée avec vos soignants, éclairée et alignée avec vos propres priorités.
Source de l’article : extrait d’une intervention du Pr Olivier CUSSENOT lors d’une journée scientifique de l’ANAMACaP
présentation de pca-tt-simulator : un outil d’aide à la décision
Il s’agit d’un outil de formation médicale développé pour les étudiants, praticiens et patients experts grâce aux recherches menées par Sorbonne Université. PCa-Tt-simulator est un système d’intelligence artificielle explicite et interactif pour enseigner les facteurs qui impactent les choix dans la prise en charge du cancer de la prostate localisé. Il ne doit pas être utilisé pour une décision médicale, et ne peut pas remplacer un professionnel de la santé. Les éléments ci-après vont vous guider à travers son utilisation, tout en soulignant les éléments clés à prendre en compte pour une interprétation éclairée des résultats.
Outil et informations publiées sur le site de l’ANAMACaP avec l’aimable autorisation du Pr Olivier CUSSENOT, Président du conseil scientifique de l’ANAMACaP et ancien chef du service urologie de l’hôpital Tenon, hôpitaux de l’est parisien, Sorbonne université.
CONDITIONS D’UTILISATION : Les résultats fournis par cet outil sont uniquement à des fins de formation et ne sont pas destinés à remplacer les conseils ou avis médicaux professionnels. En utilisant cet outil, vous reconnaissez et acceptez les conditions suivantes : Sauf autorisation légale contraire, cet outil ne peut être utilisé, pour une étude privée ou une recherche non commerciale. Vous ne devez pas copier, reproduire, distribuer, transmettre, diffuser, afficher, vendre, louer, concéder sous licence ou exploiter autrement cet outil ou tout contenu, en tout ou en partie, à d’autres fins sans le consentement écrit préalable de Sorbonne Université Médecine, le Centre de Recherche sur les pathologies prostatiques. Les auteurs n’assument aucune responsabilité pour les erreurs de prévision ou les résultats du modèle. Les liens de cet outil ou tout texte associé n’impliquent aucune recommandation ou approbation de produits ou de services. Cet outil est la propriété de Sorbonne Université et de ses partenaires. Copyright © 2019 Sorbonne Université. Tous les droits sont réservés.
Les risques d’évolution de la maladie qui définissent le type de traitement
Les risques d’évolution d’un cancer de la prostate sont définis par les caractéristiques cliniques et anatomo-pathologiques de la maladie. Voici les champs à compléter dans l’outil PCa-Tt-simulator :
Les scores ISUP ou de Gleason évalués à partir des biopsies de la prostate.
La taille de la tumeur : elle correspond au plus grand diamètre tumoral mesuré sur l’IRM. A défaut la plus grande longueur de cancer mesuré sur les biopsies peut être retenue. Elle est moins fiable que la mesure en IRM, en particulier si les biopsies non pas été réalisées de façon ciblée en fusion d’image avec l’IRM.
Le contact capsulaire : il est évalué en IRM. Si la tumeur est à distance de la capsule (limite périphérique de la prostate) : il n’y a pas de contact capsulaire. Si la tumeur vient au contact de la capsule sans la modifier, il y a contact capsulaire. Si la tumeur modifie la capsule en l’infiltrant ou en la dépassant dans l’espace périprostatique ou au niveau de la base des vésicules séminales, le cancer est considéré comme localement avancé.
L’ADC (coefficient apparent de diffusion) : la cartographie ADC est évaluée par l’IRM prostatique multiparamétrique. Il existe une corrélation inversement proportionnelle entre le score ADC et l’agressivité tumorale. Une restriction de l’ ADC < 800 correspond le plus souvent à des lésions de score ISUP > 1.
Le taux de PSA : Le PSA est fortement exprimé dans les secrétions prostatiques. Il existe une variabilité individuelle des valeurs du PSA sanguin indépendamment de la présence d’un cancer de la prostate notamment par le volume de la prostate et le déficit androgénique. Il est possible de personnaliser le seuil du taux de PSA en le corrigeant (normalisant) sur ces facteurs :
- Le volume de la prostate entraîne une augmentation naturelle du taux de PSA, ce qui peut donner une impression exagérée de l’évolution du cancer.
- Le déficit androgénique: il diminue le taux de PSA en réduisant sa production par les cellules prostatiques cancéreuses, ce qui peut conduire à sous-estimer la progression du cancer. Les facteurs à l’origine du déficit androgénique sont la réduction du taux de testostérone lié à l’âge (Andropause) et l’obésité ou l’utilisation de certains médicaments (Plus d’informations sur le PSA, le volume de la prostate et le déficit androgénique : page « outil IA pour comprendre les facteurs de risque et le diagnostic précoce du cancer de prostate »
Le taux de PSA, le volume tumoral, le statut de la capsule prostatique (stade) et le score ISUP ou de Gleason définissent un score d’évolutivité élaboré par D’AMICO en 3 niveaux : faible, intermédiaire ou élevé.
Les facteurs génétiques : certaines mutations prédisposant au cancer de la prostate sont associées à un risque d’évolution plus élevé et sont considérées comme un facteur aggravant (gènes BRCA2 ou HOXB13).
Les risques liés aux autres causes de mortalité appelées co-morbidités
Indépendamment du cancer, ces risques déterminent l’espérance de vie. Il s’agit d’évaluer l’avantage potentiel d’un traitement immédiat pour prolonger la durée de vie, en le comparant aux risques liés à d’autres causes de décès.
L’âge, corrélé à l’espérance de vie.
Les co-morbidités : elles correspondent à d’autres maladies qui peuvent impacter l’espérance de vie en dehors du cancer. Leur impact sur l’espérance de vie et le risque de complication en cas d’anesthésie pour une intervention est estimé par le score ASA (Physical Status Classification System) :
- ASA-1 : Patient normal (pas de maladie, consommation d’alcool nulle ou minimale, non-fumeurs)
- ASA-2 : Patient avec anomalie systémique modérée (maladies légères uniquement sans limitations fonctionnelles, ou fumeur actif ou buveur d’alcool social, obésité (IMC + 30)
- ASA-3 : Patient avec anomalie systémique sévère (limitations fonctionnelles importantes ou une ou plusieurs maladies modérées à sévères comme le diabète ou l’hypertension artérielle mal contrôlés, BPCO, obésité morbide (IMC ≥40), hépatite active, dépendance ou abus d’alcool, stimulateur cardiaque implanté, réduction modérée de la fraction d’éjection, dialyse pour insuffisance rénale, cardiopathie ischémique compliquée (> 3 mois).
- ASA-4 : Patient avec anomalie systémique sévère représentant une menace vitale constante (cardiopathie ischémique compliquée récente (< 3 mois) ou dysfonctionnement valvulaire sévère, réduction sévère de la fraction d’éjection.
Les options de prise en charge
Elles se divisent en surveillance active, traitement curatif, traitement palliatif. Pour un même risque évolutif, il y a souvent plusieurs options thérapeutiques qui donnent le même taux de guérison du cancer, leur choix dépendra alors des attendus en termes de qualité de vie du patient.
La surveillance active consiste à ne proposer un traitement curatif que si le cancer montre des signes d’évolutivité. Elle s’applique aux tumeurs de faible risque évolutif. En effet à 10 ans, seulement 30% de ces tumeurs augmentent de volume ou changent de score ISUP / Gleason.
Les traitements curatifs : ils traitent toute la prostate contenant le foyer cancéreux :
- La prostatectomie vise à retirer toute la prostate et les vésicules séminales.
- La curiethérapie consiste à implanter, sous anesthésie générale, dans la prostate des grains métalliques (le plus souvent d’Iode 125) émettant une radioactivité temporaire
- La radiothérapie externe, elle consiste à délivrer sur la prostate une dose définie de radiations. Le volume irradié (conformationnel tridimensionnel) est guidé par l’imagerie de façon prédéfinie ou en temps réel. Elle peut être exclusive ou associée à une période de 6 à 24 mois) de privation androgénique (traitement hormonal)
- Les ultrasons focalisés de haute intensité (HIFU) ils sont délivrés sous anesthésie par voie rectale sous contrôle échographique.
Le traitement palliatif est un traitement par privation androgénique (appelé communément traitement hormonal). Il peut être différé à l’apparition des symptômes liés au cancer.
Les effets secondaires des traitements
Les plus fréquents sont urinaires (en particulier les fuites d’urine ou incontinence urinaire), sexuels avec la perte des érections ou digestifs avec des troubles de l’exonération des selles (diarrhées, saignements dans les selles, incontinence anale, douleurs). Ces effets ont été comparés entre les principaux traitements curatifs dans différentes études (Donovan JL et al ; 2016) avec des échelles de gravité des symptômes. (exemple : The Expanded Prostate Cancer Index Composite – EPIC https://medicine.umich.edu/dept/urology/research/epic ).
L’estimation du risque d’effet secondaire selon le traitement calculé dans PCaLoc-Tt-simulator est définie à partir d’une référence normale (absence de trouble). Sur le plan urinaire la référence normale correspond à l’absence de symptômes urinaires, en tolérant au maximum une fuite d’urine par jour. Sur le plan sexuel une référence normale correspond au maintien des érections spontanément ou avec la prise de comprimés inhibiteurs de Phosphodiesterase de type 5 (sildenafil, tadalafil et vardénafil, avanafil). Sur le plan digestif, la référence normale correspond à l’absence de symptômes digestifs.
Réalisation de l’outil Pca-Tt-simulator
PCaLoc-Tt-simulator a été élaboré à partir du programme de recherche en épidémio-génétique sur le cancer de la prostate : « étude PROGENE *». Il utilise, une base de données promue par le Centre de Recherche sur les pathologies prostatiques (CeRePP), l’expertise du groupe de recherche clinique « Analyse sémiotique des données moléculaires en onco-urologie clinique » de « Sorbonne Université Médecine » et de « Sorbonne Center for Artificial Intelligence ». Il fait référence aux recommandations professionnelles de l’Association Française d’Urologie (AFU) pour la prise en charge des cancers de la prostate localisés. Il a comme support un modèle de réseau Bayésien, développé en accès libre sur la plateforme BayesiaLab Simulator®. Il a reçu le soutien du Fonds de Dotation pour l’innovation dans la prise en charge du Cancer de la Prostate (FDCP) créé par des patients pour des patients. *Les publications relatives à l’étude PROGENE sont disponibles sur : http://www.cerepp.org/
Mise en ligne en décembre 2024
Références de l’outil IA :
- Rozet, C. Hennequin, J.-B. Beauval, P. Beuzeboc, L. Cormier, G. Fromont-Hankard, P. Mongiat-Artus, G. Ploussard, R. Mathieu, L. Brureau, A. Ouzzane, D. Azria, I. Brenot-Rossi, G. Cancel-Tassin, O. Cussenot, X. Rebillard, T. Lebret, M. Soulié, R. Renard Penna, A. Méjean. RECOMMANDATIONS FRANÇAISES DU COMITÉ DE CANCÉROLOGIE DE L’AFU – ACTUALISATION 2018–2020 : CANCER DE LA PROSTATE. Prog Urol, 2018, 12, 28, S79, suppl. 12S.
- Donovan JL, Hamdy FC, Lane JA, Mason M, Metcalfe C, Walsh E, Blazeby JM, Peters TJ, Holding P, Bonnington S, Lennon T, Bradshaw L, Cooper D, Herbert P, Howson J, Jones A, Lyons N, Salter E, Thompson P, Tidball S, Blaikie J, Gray C, Bollina P, Catto J, Doble A, Doherty A, Gillatt D, Kockelbergh R, Kynaston H, Paul A, Powell P, Prescott S, Rosario DJ, Rowe E, Davis M, Turner EL, Martin RM, Neal DE; ProtecT Study Group*.Patient-Reported Outcomes after Monitoring, Surgery, or Radiotherapy for Prostate Cancer. N Engl J Med. 2016 Oct 13;375(15):1425-1437.

